エゾウコギの研究報告

北海道医療大学病院
北海道医療大学予防医療科学センター 准教授
河野 豊 医師/医学博士

エゾウコギ抽出物はヒト肝臓がん細胞においてルビコン蛋白質を減少することでオートファジーを活性化させている
(ONCOLOGY REPORTS 45: 1193-1201, 2021にて発表)
試験背景
肝臓癌(肝細胞癌;HCC)は世界で5番目に罹患数が多く、死因では3番目に多い癌です。HCCは慢性肝炎や肝硬変などの肝障害を背景に発症することが多いため、十分な肝予備能が保たれていないと、小さいサイズのHCCでも十分な治療(切除や焼灼術などの局所治療)が困難になります。近年ソラフェニブやレンバチニブといった、分子標的薬を用いた全身化学療法がHCCでも使用できるようになってきました。しかし切除不能HCC患者において、これらの薬物治療でも平均生存期間が約1年程度であり、未だ薬物によるHCCの十分な制御ができているとは言い難く、より効果的で安全な治療法の確立が望まれています。
エゾウコギによる抗がん作用は胃癌細胞、乳癌細胞や白血病細胞などのいくつかの癌種で知られており、これらのがん細胞にエゾウコギを曝露すると細胞死(アポトーシス)を惹起することが報告されています。そこで本研究では、エゾウコギ曝露による肝癌細胞への影響を検討することとしました。
試験方法
高分化型ヒト肝癌由来細胞株(HuH-7)および肝芽腫細胞株(HepG2)にエゾウコギ根抽出物(ASHE)を曝露して、増殖能(生存能)、コロニー形成能、細胞周期、オートファジーに関する実験(LC3-I/IIとルビコン蛋白発現、電子顕微鏡)を行いました。
試験結果
HuH-7 およびHepG2は、10%胎児ウシ血清存在下では250μg/mL ASHEまで細胞生存に影響しませんでした。一方、胎児ウシ血清が存在しない条件下ではそれより低濃度のASHEでも細胞生存の低下とコロニー形成能の低下を認めました(図1)。次に同条件下でASHE暴露時における細胞周期とアポトーシスを検討しました。ASHEは濃度依存性にG0/G1期での細胞周期の停止及びアポトーシスを起こしていることが分かりました(図2)。これらの結果からは、ASHEによる細胞生存低下の程度とアポトーシスの程度が見合っていなかったため、アポトーシス以外の細胞死が考えれらました。
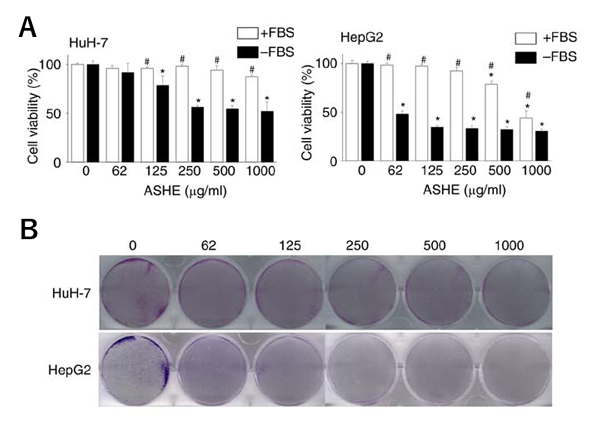
図1 ASHE暴露時のHuH-7およびHepG2の細胞増殖
A:白が10%胎児ウシ血清存在下、黒が無血清下での実験
P<0.01(*はASHE非曝露時、#は10%胎児ウシ血清存在下との比較)
B:コロニー形成能
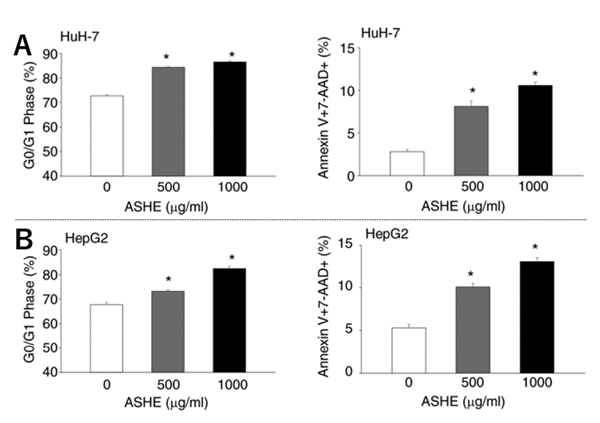
図2 ASHE暴露時のHuH-7およびHepG2の細胞周期およびアポトーシスの解析
A:HuH-7細胞B:HepG2細胞
以前の報告からエゾウコギの実にはオートファジーを調節するAMPK蛋白を活性化することによって、オートファジーによる細胞死を起こすことが知られていました。そこで根の部分にも同様の作用があるかどうかを検証するため、HuH-7 およびHepG2にASHEを曝露してAMPK蛋白及びオートファジー関連蛋白(LC3-I/LC3-II)を調べました。するとASHEはAMPK蛋白は活性化させないものの、オートファジーを活性化していることが判明しました(図3)。電子顕微鏡で観察すると、オートファジーで形成される空胞(オートファゴソームとオートリソソーム)がASHE曝露により増加していることが確認されました(図4)。
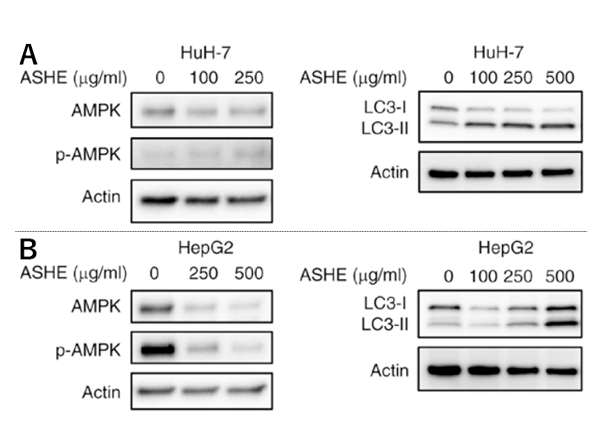
図3 ASHE暴露時のHuH-7およびHepG2のAMPKおよびLC3の蛋白発現
A:HuH-7細胞B:HepG2細胞
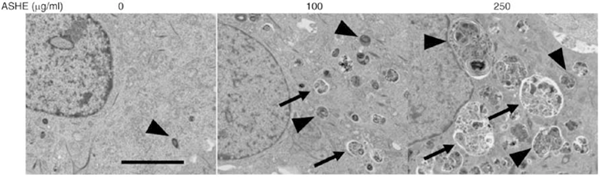
図4 ASHE暴露時のHuH-7の電子顕微鏡
矢印はオートファゴソーム、矢頭がオートリソソーム
最後に、ASHEによってオートファジーが活性化するメカニズムを調べると、オートファジーの後半のステップを抑制しているルビコン蛋白の発現がASHE曝露により減少していることが分かりました(図5)。
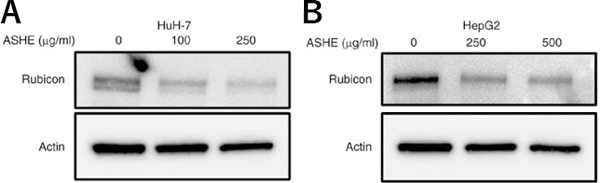
図5 ASHE暴露時のHuH-7およびHepG2のルビコン蛋白の蛋白発現
おわりに
本研究では、2種類の肝癌細胞株を用いてASHEの作用をin vitroで検討しました。ASHEにより肝癌細胞のルビコン蛋白の発現が低下することによってオートファジーが活性化しており、抗がん作用をもたらしていることが判明しました。一方、オートファジーは感染症や炎症性疾患、認知症といった様々な疾患や、老化にも深く関係していることが知られています。今後オートファジーを活性化させる物質をASHEから単離して、上述の疾患や老化への影響も検討していく予定です。